京大物理 '25 年前期 [3] 次の文章を読んで、 に適した式または数値を、 { } からは適切なものを一つ選びその番号を、それぞれの解答欄に記入せよ。なお、 はすでに で与えられたものと同じものを表す。また、問 1 ,問 2 では、指示にしたがって、解答をそれぞれの解答欄に記入せよ。 (1) 1 モルの単原子分子理想気体の状態変化について考える。絶対温度 T におけるこの気体の内部エネルギーは、 R を気体定数とすると P と体積 V の間にはポアソンの式 = 一定が成り立つ。以下、重力加速度の大きさを 図 1(a) に示すように、この理想気体を断面積が S の円筒状の容器に入れ、蓋で封じる。蓋は断熱性であり、気密性を失わずに鉛直方向に滑らかに動くことができる。容器は透熱性と断熱性に切り替えることができ、はじめ透熱性である。また、容器は十分に深く蓋が外れることはない。蓋にかかる重力による圧力と大気圧とを合わせた圧力を M のおもり O を静かに載せ、ゆっくりと気体を圧縮すると、気体の圧力と体積がそれぞれ X とする ( 図 1(b)) 。 = あ である。 X にある容器を断熱性に切り替え、外界との熱の出入りができないようにした。 ( 図 1(c)) 。また、おもり O は N 個の等価な小さなおもり c からなり、おもり c を 1 個ずつ取り除くことで気体にかかる圧力を変えることができる。ここで、 N は十分大きな正の整数で、おもり c を 1 個取り除くことによる外部から気体にかかる圧力の変化量は小さく、また気体の膨張による体積変化量も小さい。以下の操作 α を繰り返し、おもり c を 1 個ずつ取り除いていく。 操作 α :おもり c を 1 個素早く取り除き、蓋が静止するまで膨張させる
操作 α を k 回繰り返した後の理想気体の圧力と体積をそれぞれ k は 0 ~ N の整数であり、 X に対応している。 = い である。操作 α を k 回行った後にさらに操作 α を 1 回行う。このとき気体がする仕事は、 N が十分に大きいので、 う と表される。これらを用いることで、 = え × の関係式を得る。操作ごとの圧力変化と体積変化をそれぞれ + お × = 0 の関係式が得られる。 N が大きくなると 0 に近づくので、操作 α の繰り返しは、気体の圧力と体積が連続的に変化するものとみなすことができ、ポアソンの式が得られる。 X から操作 α を N 回繰り返すと、全てのおもり c が取り除かれる。図 1(c) の状態から開始して、断熱的におもり c を N 個取り除いた場合の最終的な気体の圧力と体積を 1(b) の状態から開始して、等温的におもり c を N 個取り除いた場合の最終的な気体の圧力と体積は { か:① } である。 問 1 { か } の大小関係について、理想気体の膨張による仕事と内部エネルギー変化をもとに説明せよ。
(2) 単原子分子理想気体とは異なる状態方程式や内部エネルギーの式に従う気体 F の状態変化について考える。ただし、この気体 F は考えている温度や圧力の範囲で気体として振る舞う。また、熱力学第一法則に従い、理想気体と同様に加熱すると圧力が上昇し、気体がする仕事は理想気体と同様に表される。この気体の圧力、体積、内部エネルギーをそれぞれ P , V , U とすると、気体 F について 気体 F の断熱膨張を考える。気体の体積が V から P から U から P , V , き となる。したがって、 + く × = 0 が得られる。これより、気体 F のゆっくりとした断熱変化において = 一定 ( γ = く ) の関係が成り立つことが示される。 F のエネルギー密度を u と表すと F のエネルギー密度は、絶対温度 T のみに依存し a と x は正の定数である。気体 F を作業物質とするサイクルを考えることで x を求めてみよう。このサイクルでは、図 2 に示すように、気体は状態 A →状態 B →状態 C →状態 D →状態 A のように変化し、もとに戻る。各変化は、 状態 A →状態 B :気体を断熱壁で覆った断熱変化 B →状態 C :絶対温度 C →状態 D :気体を断熱壁で覆った断熱変化 D →状態 A :絶対温度 である。ここで、各変化はゆっくりと進行し、また各状態での気体の体積と圧力は図 2 に示す通りである。以下では、状態 i から状態 j への変化で気体が得た熱を i と j は A ~ D のいずれかを指す。 B の体積 = け × F の U は P だけでなく V にも依存することに注意すると、 = こ と表される。また、 = さ となる。 ( 絶対温度 ) の熱源から得た熱を ( 絶対温度 ) の熱源から得た熱を F のサイクルにあてはめると [ し ] × [ す ] × = 0 が得られる ( ただし、 し と す は ) 。この式が任意の x = せ となる。 問 2 気体 F の定圧モル比熱は定義することができない。その理由を述べよ。 【広告】ここから広告です。ご覧の皆さまのご支援ご理解を賜りたく、よろしくお願いいたします。
【広告】広告はここまでです。
解答 断熱変化ではポアソンの関係式が成り立ちますが、これと異なる関係式のもとで変化する気体の状況を熱力学第一法則に基づいて検討する問題です。 ∴ あ ] おもり c の 1 個分の質量は c を k 個取り除いたときのおもり O の質量は、 α を k 回繰り返した後の蓋に働く力のつり合いより、 圧力 ......[ い ]k 回操作後, 理想気体 の絶対温度を k 回操作後の理想気体の状態方程式: k 回操作後から 内部エネルギー の変化 ......[ う ] 問題文より、この間に理想気体のした 仕事 は 断熱変化 より、この間に理想気体が吸収した熱は 0 であり、 熱力学第一法則 より、 ∴ 注. [ お ] の結果から、 一定 ) となりポアソンの式が得られます。
図 1(c) の状態も図 1(b) の状態も圧力、体積は 1(c) の状態から気体は断熱変化して状態 1(b) の状態から気体は 等温変化 して状態 p -V グラフは、断熱変化の方が等温変化よりも傾きが急なので、同一の状態 ......[ か ] 問 1 断熱膨張では、理想気体の温度低下による内部エネルギー変化のみが理想気体のした仕事になるが、等温膨張では、内部エネルギーの変化に加えて外部から供給された熱も仕事になる。等温膨張の方が仕事が大きいので、体積増加も大きい。 ......[ 答 ]
(2) 気体 F が断熱膨張するとき、気体の体積が F がする仕事 W は、 ......[ き ] のとき、内部エネルギーの変化は、 ・・・③ 熱力学第一法則より、断熱変化で気体が吸収する熱は 0 なので、 [ き ] の結果と合わせて、
∴ ......[ く ] これより、気体 F のゆっくりとした断熱変化において、 (1) の注.のようにすれば、 = 一定 ・・・ ( * ) の関係が成り立つことがわかります。 A から状態 B への断熱変化において ( * ) より、 ......[ け ] 状態 B から状態 C への気体 F の温度 ( ∵ [ き ]) と内部エネルギーの変化 ( ∵ ③ ) の和となり、 ......[ こ ] 同様に、状態 D から状態 A への気体 F の温度 ......[ さ ] [ け ] の結果、 [ け ] と同様に成り立つ 4 で割ると、 ・・・③ ......[ し ] , ......[ す ] ③が任意の 恒等式 の条件より、 , ∴ これより、 ......[ せ ] 問 2 図 2 によると、状態 D →状態 A の変化いおいて、定圧変化であるにもかかわらず、温度変化も 0 であるため、 定圧モル比熱 が定義できない。 ......[ 答 ] 【広告】ここから広告です。ご覧の皆さまのご支援ご理解を賜りたく、よろしくお願いいたします。
【広告】広告はここまでです。
京大物理 TOP 物理 TOP TOP ページに戻る 【広告】ここから広告です。ご覧の皆さまのご支援ご理解を賜りたく、よろしくお願いいたします。
【広告】広告はここまでです。 各問題の著作権は © 2005-2025 (有)りるらる 苦学楽学塾 随時入会受付中! 理系大学受験ネット塾 苦学楽学塾 (ご案内はこちら )ご入会は、こちらまでメール を 
 ......[え]
......[え]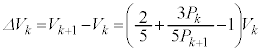
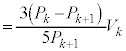
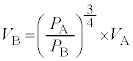
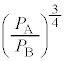 ......[け]
......[け]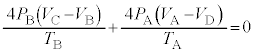
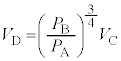 を代入し、分母を払い4で割ると、
を代入し、分母を払い4で割ると、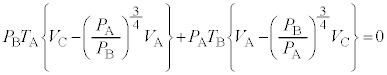
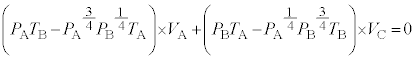 ・・・③
・・・③